Termodinamik, ısı ve öteki enerji biçimleri arasındaki ilişkilerle ilgilenen fizik dalıdır. Bilhassa, termal enerjinin öteki enerji formlarına iyi mi dönüştürüldüğünü ve termal enerjinin maddeyi iyi mi etkilediğini açıklar.
Termal enerji, bir maddenin yada sistemin sıcaklığından dolayı haiz olduğu enerjidir. Başka bir deyişle, Kentucky Üniversitesi’ne gore hareket eden yada titreyen moleküllerin enerjisidir. Missouri Southern State Üniversitesi’nde fizik profesörü olan David McKee, verdiği demeçte, termodinamik, “aşırı derecede karmaşık” olabilen bu enerjiyi ölçmeyi ihtiva eder.

“Termodinamikte incelediğimiz sistemler oldukça büyük sayıda atomdan oluşur, yada karmaşık yollarla etkileşime giren moleküller. Sadece bu sistemler denge dediğimiz doğru kriterleri sağlıyorsa oldukça azca sayıda ölçüm yada sayı ile tanımlanabilirler. Çoğu zaman bu, sistemin hacmi, sistemin basıncı ve sistemin hacmi yada başka bir eşdeğer sayı kümesi olarak idealleştirilir.”
Isı

O halde termodinamik, maddenin çeşitli özellikleriyle ilgilenir; Bunların başlangıcında ısı gelir. Georgia Eyalet Üniversitesi’ne gore ısı, aralarındaki ısı farkı sebebiyle maddeler yada sistemler içinde aktarılan enerjidir. Bir enerji biçimi olarak ısı korunur – yaratılamaz yada yok edilemez. Sadece bir yerden başka bir yere aktarılabilir.
Isı ek olarak öteki enerji formlarına dönüştürülebilir. Mesela, bir buğu türbini, kinetik enerjiyi elektrik enerjisine dönüştüren bir jeneratörü çalıştırmak için ısıyı kinetik enerjiye dönüştürebilir. Bir ampul, bu elektrik enerjisini, bir yüzey tarafınca emildiğinde yeniden ısıya dönüştürülen elektromanyetik radyasyona (ışık) dönüştürebilir. Bu süreç süresince, enerjinin bir kısmı entropiye dönüşür.
Georgia State Üniversitesi’ne gore, bir madde tarafınca aktarılan ısı miktarı, hareket halindeki o maddenin atomlarının yada moleküllerinin hızına ve sayısına bağlıdır. Atomlar yada moleküller ne kadar süratli hareket ederse, ısı o denli yüksek olur ve hareket halindeki atomlar yada moleküller ne kadar fazlaysa, aktardıkları ısı miktarı o denli büyük olur.
American Heritage Dictionary’e gore ısı, “standart bir ölçekte belirlenmiş birimler yada dereceler cinsinden anlatılan, bir madde örneğindeki parçacıkların averaj kinetik enerjisinin bir ölçüsüdür”. En yaygın olarak kullanılan ısı ölçeği, suyun donma ve kaynama noktalarını temel alan ve sırasıyla 0 C ve 100 C değerlerini atayan Celsius’tur. Fahrenheit ölçeği ek olarak, atanmış değerlere haiz suyun donma ve kaynama noktalarına da dayanır. Sırasıyla 32 aşama Fahrenheit ve 212 F.
Bununla beraber, dünya çapındaki bilim adamları, İskoçya Ulusal Kütüphanesine gore, suyun donma ve kaynama noktalarından ziyade toplam termal enerjiye dayandığından, William Thomson, 1. . Bu ölçek, Celsius ölçeğiyle aynı artışları kullanır; mesela, 1 C’lik bir ısı değişimi 1 K’ye eşittir. Bununla beraber, Kelvin ölçeği mutlak sıfırda, şu demek oluyor ki toplam ısı enerjisinin bulunmadığı sıcaklıkta adım atar ve tüm moleküler hareket durur. 0 K ısı eksi 459.67 F yada eksi 273.15 C’ye eşittir.
Özısı
Wolfram Research’e gore, bir maddenin belirli bir hacminin sıcaklığını belirli bir oranda çoğaltmak için ihtiyaç duyulan ısı miktarına özgül ısı yada özgül ısı kapasitesi denir . Bunun için geleneksel birim Kelvin başına gram başına kaloridir. Kalori, 1 gram suyun sıcaklığını 4 C’de 1 aşama yükseltmek için ihtiyaç duyulan ısı enerjisi miktarı olarak tanımlanır.
Bir metalin özgül ısısı, numunenin kütlesine değil, neredeyse tamamen numunedeki atom sayısına ve bunların bağlanma şekline bağlıdır. Mesela, bir kilogram alüminyum , bir kilogram kurşundan ortalama yedi kat daha çok ısı emebilir . Bununla beraber, Güneydoğu Louisiana Üniversitesi’ne gore, belirli bir su hacmi, su moleküllerini bağlayan kuvvetli kuvvetler yardımıyla, eşit bir alüminyum kütlesinden ortalama beş kat daha çok ısı emebilir .
Termal İletkenlik

Termal iletkenlik ( k ), Debdatta Ratna’nın “Thermosets” adlı kitabına gore (Woodhead Publishing limited, 2012) “belirli bir malzemenin belirli bir kesitinden ısının geçme hızı”dır. Swarthmore College’a gore k birimi, Kelvin (K) başına metre (m) başına watt (W)’dir . Bakır ve gümüş şeklinde metaller için k değerleri sırasıyla 380 ve 420 W/m·K’de nispeten yüksektir.
Bu özellik, bu malzemeleri otomobil radyatörleri ve bilgisayar çipleri için soğutma kanatçıkları için kullanışlı hale getirir, zira bunlar ısıyı süratli bir halde taşıyıp çevre ile değiş tokuş edebilirler. K’nin en yüksek kıymeti Materials dergisinde gösterilen 2009 tarihindeki bir araştırmaya gore, herhangi bir naturel madde için 2.200 W/m·K değerinde elmas bulunur .
Öteki malzemeler, son aşama zayıf ısı iletkenleri oldukları için yararlıdır; bu özellik, ısıl direnç yada ısının araç-gereç yöntemiyle iletilme hızını tanımlayan R kıymeti olarak adlandırılır. Fiberglas, kaz tüyü ve strafor şeklinde bu malzemeler, dış cephe duvarlarında, kışlık mantolarda ve termal kahve kupalarında yalıtım için kullanılmaktadır. Açık kaynaklı bir ders kitabı olan OpenStax’a gore R kıymeti, İngiliz ısı birimi (ft2·°F·h/Btu) başına fit kare çarpı aşama Fahrenheit çarpı saat cinsinden verilir.
Newton’un Soğutma Yasası
1701’de Sir Isaac Newton , Royal Society’nin Felsefi İşlemlerinde “Scala graduum Caloris” (“Isı Derecelerinin Bir Ölçeği”) başlıklı kısa bir makalede Soğutma Yasasını ilk kez dile getirdi . Newton’un yasayla ilgili ifadesi, orijinal Latince’den “ısı derecelerinin fazlalığı … zamanlar aritmetik bir ilerlemedeyken geometrik ilerlemedeydi” olarak çeviri edilir.
Worcester Polytechnic Institute, bu bilimsel yasanın daha çağıl bir versiyonunu “sıcaklığın değişiklik hızı, nesnenin sıcaklığı ile çevreleyen ortamın sıcaklığı arasındaki farkla orantılıdır” şeklinde verir.
Bu , ısı bilincinde üstel bir azalmaya niçin olur. Mesela, soğuk bir banyoya ılık bir cisim konursa, belirli bir süre içinde iki ısı arasındaki fark yarı yarıya azalacaktır. Hemen sonra aynı süre içinde kalan fark gene yarı yarıya azalacaktır. Isı farkının bu tekrarlanan yarıya bölünmesi, ölçülemeyecek kadar ufak olana kadar eşit vakit aralıklarında devam edecektir. Bu aşamada, sistem termal dengededir.
Isı Transferi
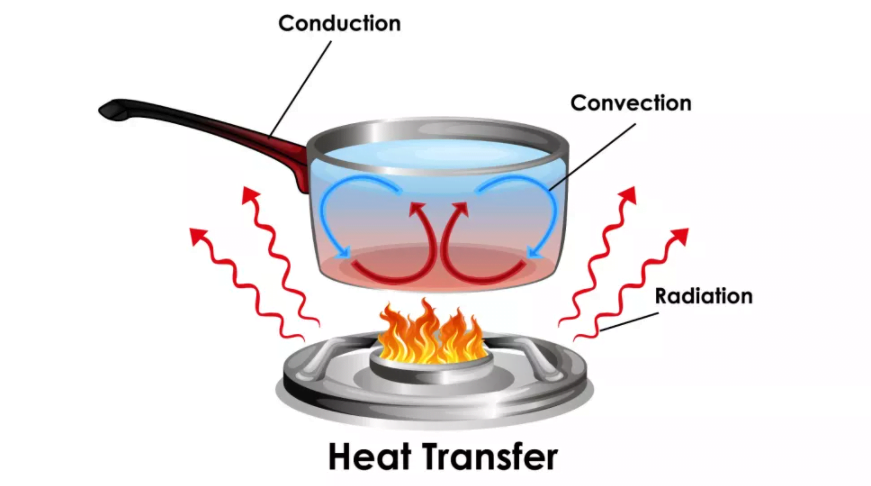
Isı transferinin iyi mi çalıştığını gösteren diyagram.(Fotoğraf kredisi: Getty Images vesilesiyle blueringmedia)Isı, bir vücuttan diğerine yada bir vücut ile çevre içinde üç değişik yolla aktarılabilir: iletim, taşınım ve ışınım. İletim, enerjinin katı bir maddeden aktarılmasıdır. Cisimler arasındaki iletim, direkt temas halinde olduklarında meydana gelir ve moleküller enerjilerini arayüz süresince aktarır.
Konveksiyon, ısının akışkan bir ortama yada ortamdan aktarılmasıdır. Katı bir cisimle temas halindeki bir gaz yada sıvıdaki moleküller, o cisimden yada cisme ısı iletir yada emer ve sonrasında uzaklaşarak sıvının öteki moleküllerinin yerlerine hareket etmesine ve işlemi tekrarlamasına izin verir.
Işınım, elektromanyetik (EM) ışınım , bilhassa ısı enerjisi taşıyan kızılötesi fotonlar yöntemiyle enerji emisyonudur. Northwestern Üniversitesi’ne gore, tüm maddeler bir miktar EM radyasyonu yayar ve emer; bunun net miktarı, bunun ısıda bir yitik yada artışa niçin olup olmadığını belirler .
Carnot Döngüsü
1824’te Nicolas Léonard Sadi Carnot , Amerikan Makine Mühendisleri Derneği’ne gore, Carnot çevrimi olarak malum şeye dayanan bir ısı motoru için bir model önerdi. Döngü, gazların basıncı, hacmi ve sıcaklığı arasındaki ilişkilerin yanı sıra bir enerji girişinin iyi mi şekil değiştirebileceğini ve sistem haricinde iyi mi iş yapabileceğini kullanır.
Carnot çevrimindeki ilk adım, izotermal genleşmedir, burada bir pistondan gelen tazyik altında bir silindirdeki gaz durağan(durgun) bir sıcaklıkta tutulur, sadece bir ısı deposu silindirle temas ettirilir. Aynı sıcaklığı korumak için gazın genleşmesi gerekir. Hemen sonra, adyabatik genişleme yada çevreye ısı transferi olmadan genişleme, gazın daha çok genişlemesine izin vermek için pistondan ağırlığı kaldırır, bu da iş yapmak için bir silindiri itmesine destek sağlar. (Adyabatik, termodinamikte emek verme akışkanında ısı ve kütle kaybının yada kazancının olmadığı haldeki süreçtir.)
Hemen sonra, gaz durağan(durgun) bir sıcaklıkta soğutulur ve gazdaki basıncı yükseltmek için pistona ağırlık eklendikten sonra sıkıştırılır, bu aşamada ısı gazdan ısı kaynağına geri döner. Son olarak, adyabatik sıkıştırma, gazın basıncını daha da çoğaltmak ve dolayısıyla sıcaklığını çoğaltmak için pistona daha çok ağırlık ekler. Hemen sonra döngü, duruma gore tekrarlanır. NASA’ya. Georgia Eyalet Üniversitesi’ne gore ısıtma, iklimlendirme ve soğutma için kullanılan ısı pompalarının arkasındaki temel ilke budur .
Termodinamik ve Entropi

Tüm termodinamik sistemler atık ısı üretir. Bu atık, bir sistemin düzensizliğinin bir ölçüsü olan entropide bir artışa niçin olur. İş, tertipli moleküler hareketten geldiğinden, Britannica’ya gore entropi, iş yapmak için mevcut olmayan enerjinin bir ölçüsüdür . Herhangi bir kapalı sistemde entropi devamlı artar; asla azalmaz . Ek olarak, hareketli parçalar sürtünme sebebiyle atık ısı üretir ve sistemden ışıma ısısı kaçınılmaz olarak sızar.
Bu, sözde devamlı hareket makinelerini olanaksız hale getirir. Missouri Eyalet Üniversitesi’nde fizik profesörü olan Siabal Mitra, şunları söylemiş oldu: “% 100 verimli bir motor yapamazsınız, bu da devamlı bir hareket makinesi yapamazsınız anlamına gelir. Sadece, dışarıda hala yapmayan birçok insan var. Buna inanmayın ve hala devamlı hareket eden makineler halletmeye çalışan insanoğlu var.”
Entropi hem de “kapalı bir sistemdeki düzensizliğin yada rastgeleliğin bir ölçüsü” olarak da tanımlanır ve bu da kaçınılmaz olarak artar. Sıcak ve soğuk suyu karıştırabilirsiniz, sadece büyük bir bardak ılık su, sıcak ve soğuk su içeren iki ufak bardaktan daha düzensiz olduğundan, sisteme enerji eklemeden asla yeniden sıcak ve soğuk olarak ayıramazsınız. Başka bir deyişle, bir yumurtayı çözemez yada kahvenizden krema çıkaramazsınız. Bundan dolayı entropi bizlere bir vakit oku sağlar: ileri, artan entropinin yönüdür.
Termodinamik Yasaları

Termodinamiğin temel ilkeleri başlangıçta üç yasada ifade edildi. Hemen sonra bilim adamları, daha temel bir yasanın, açıkça belirtilmesine gerek kalmayacak kadar açık görünmüş olduğu için dikkatsizlik edildiğini anladılar. Eksiksiz bir kurallar dizisi oluşturmak için bilim adamları, bu en temel yasanın dahil edilmesi gerektiğine karar verdiler. Sadece mesele, ilk üç yasanın aslına bakarsanız kurulmuş olması ve atanan numaralarıyla iyi bilinmesiydi.
Mühim bir kafa karışıklığına yol açabilecek mevcut yasaları tekrardan numaralandırma ya da en mühim yasayı listenin sonuna koyma olasılığıyla karşı karşıya kaldığında, ki bu hiçbir mantıklı anlam ifade etmeyecekti, İngiliz fizikçi Ralph H. Fowler, ikilemi çözdü: yeni yasaya “Sıfırıncı Yasa” adını verdi.
Termodinamik yasaları kaç tanedir?
İşte özetlemek gerekirse, dört termodinamik yasası:
Termodinamiğin Sıfırıncı Yasası, iki cisim üçüncü bir cisimle termal dengedeyse, o vakit birbirleriyle de dengede olduklarını belirtir. Bu, sıcaklığı maddenin temel ve ölçülebilir bir özelliği olarak belirler.
Termodinamiğin Birinci Yasası, bir sistemin enerjisindeki toplam artışın, termal enerjideki artış ile sistem üstünde meydana getirilen işin toplamına eşit bulunduğunu belirtir. Bu, ısının bir enerji biçimi bulunduğunu ve bundan dolayı korunum ilkesine doğal olarak bulunduğunu belirtir – şu demek oluyor ki ne yaratılabilir ne de yok edilebilir.
Termodinamiğin İkinci Yasası, ısı enerjisinin daha düşük sıcaklıktaki bir vücuttan daha yüksek sıcaklıktaki bir vücuda enerji ilavesi olmadan aktarılamayacağını belirtir. Bundan dolayı bir klimayı çalıştırmak için para harcamak gerekir.
Termodinamiğin Üçüncü Yasası, muhteşem bir kristalin – şu demek oluyor ki muhteşem bir halde düzenlenmiş, bakışımlı bir modelde düzenlenmiş atomlardan oluşan bir maddenin – mutlak sıfırda entropisinin sıfır bulunduğunu belirtir.
Yukarıda açıklanmış olduğu şeklinde, entropi kimi zaman “atık enerji” yada iş yapamayan enerji olarak adlandırılır; ve mutlak sıfırda herhangi bir ısı enerjisi olmadığından, atık enerji de olması imkansız. Entropi hem de bir sistemdeki düzensizliğin bir ölçüsüdür ve muhteşem bir kristal tarif gereği muhteşem bir halde düzenlenmiş olsa da, herhangi bir pozitif ısı kıymeti, kristal içinde düzensizliğe yol açan hareket olduğu anlamına gelir. Bu nedenlerle, daha düşük entropili fizyolojik bir sistem olması imkansız, bundan dolayı entropi devamlı pozitif bir değere haizdir.
Termodinamik bilimi yüzyıllar süresince gelişmiştir ve ilkeleri şimdiye kadar buluş edilen neredeyse her aygıt için geçerlidir. Çağıl teknolojideki önemi göz ardı edilemez.
Nimet Kılıç