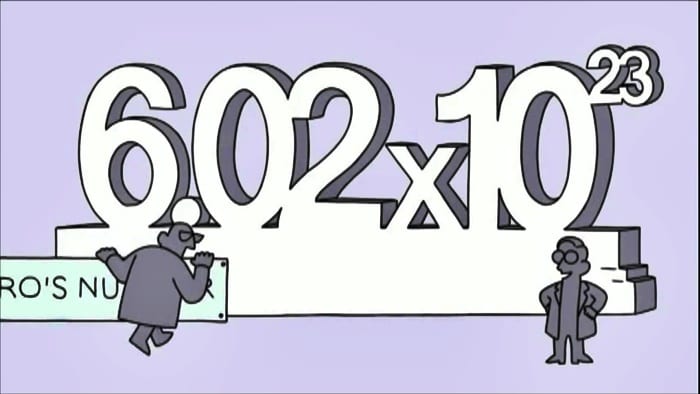Bir ipucu verelim: 867-5309 değil. Bu, 1980’lerin meşhur şarkısında bahsedilen Jenny’nin telefon numarası. Ek olarak bu sayıları halk tuvaletlerinin duvarlarına keçeli kalemle alelacele yazılmış şekilde de göremezsiniz. Avogadro sayısını bayağı bir kimya kitabının sayfalarında bulabilirsiniz: 6.0221415 × 102323. Açık şekilde yazılışı ise şöyledir: 602,214,150,000,000,000,000,000. Okumaya zamanınız yok mu? Özetlemek gerekirse “mol” diyin.
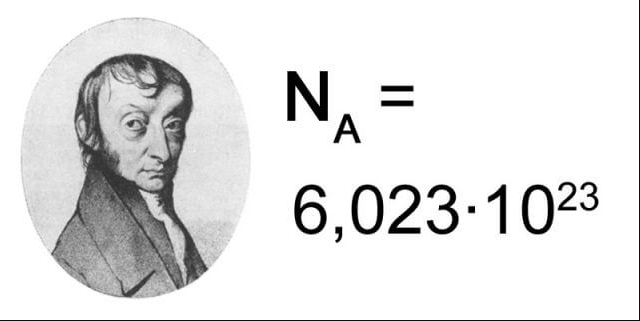
Tıpkı düzinenin 12 tane şeyden oluşması şeklinde, bir mol de Avogadro sayısı kadar şeyden oluşmaktadır. Kimyada bu “şeylere” atom yada molekül denir. Teoride, bir mol beysbol topunuz yada herhangi bir şeyiniz olabilir. Sadece bir mol beysbol topunun Dünya’yı birkaç yüz mil yüksekliğe kadar kaplayacağını göz önüne alırsanız, bir molekülden daha büyük herhangi bir şeyin molü için pek de iyi bir kullanım bulamazsınız.
Peki eğer mol yalnızca kimyada kullanılıyorsa, Amedeo Avogadro ve kimyanın yolları iyi mi kesişti?
1776 senesinde İtalya’da doğan Avogadro kimyanın gelişiminde mühim bir dönemde büyüdü. John Dalton ve Joseph Louis Gay-Lussac şeklinde kimyacılar atom ve moleküllerin temel özelliklerini anlamaya başlamışlardı. Bu son aşama minik parçaların iyi mi davrandıklarını sıkça tartışıyorlardı. Bilhassa Gay-Lussac’ın toplam hacim yasası Avogadro’nun ilgisini çekmiştir. Bu yasaya gore; iki gaz, üçüncü bir gaz oluşturmak için birbiriyle tepkimeye girdiğinde, tepkimeye giren maddeler arasındaki oran ve ürünün hacmi devamlı rahat tam sayılara eşittir. Mesela: iki su buharı oluşturmak için (ısı yeterliyse), iki hidrojen gazı bir oksijen gazıyla birleşir ve geriye hiçbir şey bırakmaz, yada:
2H2 + O2 –> 2H2O
Avogadro, bu yasanın çıkarımlarıyla uğraşırken, doğru olabilmesi için eşit hacimdeki herhangi iki gazın aynı ısı ve basınçta eşit sayıda parçacığa haiz olması icap ettiğini anlamış oldu (Avogadro yasası). Ve bu yasanın, azca ilkin bahsettiğimiz örnek de dahil olmak suretiyle, her örnek için doğru olabilmesi, sadece atomlar ve moleküller içinde bir fark olmasıyla ve oksijen şeklinde bazı elementlerin aslına bakarsak molekül olarak var olmasıyla mümkün olabilirdi. (Oksijenin durumunda yalnızca O yerine O2).
Kuşkusuz, Avogadro teorisini anlatırken dağarcığında “molekül” şeklinde kelimeler yoktu
Fikirlerine John Dalton da dahil olmak suretiyle birçok şahıs tarafınca karşı konuldu. Avogadro’nun fikirlerine hak etmiş olduğu kıymeti gösteren şahıs Stanislao Cannizzaro isminde bir öteki kimyacıydı. Bu fikirler ilgi gördüğünde ise, Avogadro çoktan vefat etmişti. Peki Avogadro sayısı bunun neresinde yer ediniyor? Avogadro yasası kimyanın gelişmesinde fazlaca mühim olduğundan kimyacı Jean Baptiste Perrin, Avogadro’nun şerefine sayıya adını vermiştir. Kimyacıların Avogadro sayısına iyi mi karar verdiklerini ve günümüzde dahi niçin kimyanın mühim bir parçası bulunduğunu öğrenmek için okumaya devam edin.
Avogadro Kanunu Nedir?
Avogadro yasası , aynı ısı ve tazyik koşulları altında , eşit hacimlerde değişik gazların eşit sayıda molekül içerdiğini belirten bir ifade. Bu ampirik ilişki, muhteşem (ideal) bir gaz varsayımı altında gazların kinetik teorisinden türetilebilir . Kanun, yeterince düşük basınçlarda ve yüksek sıcaklıklarda gerçek gazlar için ortalama olarak geçerlidir.
Gram cinsinden moleküler ağırlık olarak tanımlanan bir maddenin bir gram molündeki spesifik molekül sayısı 6.02214076 × 10 23’tür , Avogadro sayısı olarak adlandırılan bir miktardır veyaAvogadro sabiti . Mesela, oksijenin moleküler ağırlığı 32.00’dir , böylece bir gram-mol oksijenin hacmi 32.00 gramdır ve 6.02214076 × 1023 molekül ihtiva eder.
Avogadro Sayısı’nın Kullanımı
Kimyacılar görünürde rastgele olan bir sayıya, Avogadro sayısına, iyi mi karar verdiler? Bunu idrak etmek için, ilk olarak atomik hacim birimini (amu) ele almamız gerekir. Atomik kütle birimi, bir karbon-12 (en yaygın karbon izotopu) atomunun hacminin 1/12 olması olarak tanımlanmaktadır. Açıklaması da şu şekilde: Karbon-12’nin 6 protonu, 6 elektronu ve 6 nötronu vardır. Elektronların kütleleri fazlaca minik olduğundan, bir karbon-12 atom hacminin 1/12’si yalnızca bir protonun yada nötronun kütlesine fazlaca yakındır. Elementlerin atom ağırlıkları da atom kütle birimleriyle açıklanır. Mesela, hidrojenin averaj atom ağırlığı 1.00794 amu’dur.
Maalesef, kimyacıların atom kütle birimlerini ölçen bir tartıları bulunmamakta ve bir tepkimeyi gerçekleştirmek için bir atomu yada molekülü tartma şeklinde bir kabiliyetleri yoktur. Değişik atomların ağırlıkları da değişik olduğundan, kimyacıların atom ve moleküllerin görünmeyen dünyası ile tartılarla dolu kimya laboratuvarlarının uygulama dünyası arasındaki boşluğu doldurmak amacıyla bir yöntem bulmaları lazımdı. Bunu yapmak için, atom kütle birimleri ve gram içinde bir bağlantı kurdular:
1 amu = 1/6.0221415 x 1023
Bu bağlantı, Avogadro sayısı kadar yada bir mol karbon-12 atomuna haiz olsaydık; bu karbon-12 örneğinin tam olarak 12 gram ağırlığında olacağı anlamına geliyor. Kimyacılar bu bağlantıyı ölçülebilir gram birimi ile görünmeyen mol, atom yada molekül birimi içinde kolayca dönüştürme yapmak için kullanıyorlar.

Avogadro sayısının ne işe yaradığını öğrendiğimize gore;
Son bir suali incelmemiz gerekiyor. Kimyacılar ilk başta, bir molün içinde kaç atom olduğuna iyi mi karar verdiler? İlk kaba tahmin elektronun yükünü ölçen fizikçi Robert Milikan’dan geldi. Faraday denen molün elektron yükü, Milikan bulduğunda aslına bakarsanız biliniyordu.
Bir Faraday’ı elektron yüküne böldüğümüzde, bizlere Avogadro sayısını verir. Bilim adamları zaman içinde Avogadro sayısını bulmanın yeni ve daha doğru yöntemlerini keşfettiler. En yenisi ise 1 kilogramlık bir silikon küresinin geometrisini incelemek için X ışınlarını kullanmak. Bu verilerden ihtiva ettiği atomların sayısını hesaplamak şeklinde gelişmiş teknikleri kullanmaktır. Kilogram, tüm kütle birim değerlerinin temeli olsa da; bazı bilim adamları, şu anda bir metrenin uzunluğunu tam tersi yerine ışık hızına gore tanımladığımız şeklinde, kilogram yerine Avogadro sayısını kullanmaya adım atmak istiyorlar.
Çeviren: Gamze Bıçakcı